医药外包行业在国内起步晚,但成长很快,目前国内CRO、CMO公司(CRO,合同研究组织,即为医药研发的外包;CMO,医药定制研发生产,即为医药生产的外包。)主要客户资源仍以海外制药公司为主。在新的药审政策环境下,未来随着全球多临床中心数据的同步接受、优先审评带来的海外创新药进口步伐加快,将极大利好国内CRO、CMO相关企业。
参考观研天下发布《2019年中国生物医药外包市场分析报告-市场现状调查与投资战略研究》
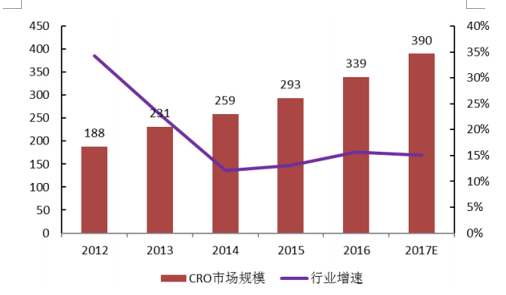

除了海外医药产品的研发生产促进国内外包行业发展这一固有驱动因素外,国内的新药研发、仿制药一致性评价和药品上市许可持有人制度(MAH)的实施将同时为外包行业打开国内市场空间:
1.仿制药一致性评价
作为国内仿制药品存量市场的供给侧改革,首批一致性评价品种为289个,对应文号数量为1.78万个,由于一致性评价的BE部分更多是要靠临床CRO与临床机构对接完成。考虑到目前市场上单个一致性评价品种的报价已达到600-800万以上,而这其中BE部分费用已达300-500万左右,综合考虑首批一致性评价品种的竞争格局、临床机构数量、BE费用等情况,我们保守估计只有20%参与BE,这给临床CRO行业带来的市场增量空间也将达到100亿。随着一致性评价工作已逐渐延伸到289品种以外的其他仿制药品种,因此CRO行业将是仿制药行业供给侧改革中最具确定性的受益行业之一。
2.MAH的实施
2016年6月,国务院正式发布医药上市许可持有人制度试点方案的通知,该制度将先行在国内10个省市开展试点。MAH最核心的内容就是允许药品批准文号和生产许可脱离,允许试点的药品研发机构和科研人员取得药品的批准文号,并且对药品质量承担相应的责任。该制度的实施,一举改变了过去药品上市许可和生产许可统一捆绑的管理模式,降低了新药研发的投资门槛。未来几年在MAH制度推广施行、CMO行业发生地区性转移、优先审评制度加快重磅创新药国内市场放量等因素作用下,国内CMO行业将迎来重要发展机遇期。
结合新的药审政策、相关行业政策引导,建议密切关注以下相关投资机会:综合研发实力较强、储备品种丰富的创新药和优质仿制药企业;海外制剂出口品种丰富的相关企业;国内CRO、CMO行业龙头公司等。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。









