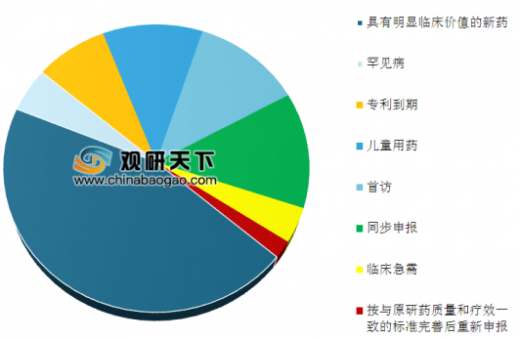
2016年2月26日,CFDA发布《关于解决药品注册申请积压实行优先审评审批的意见》,正式确定了三类可优先审评审批药品的范围:创新药、儿童用药、临床亟需药、专利过期药和首仿药等受到重点扶持。截至2017年底,药审中心共将25批423件注册申请纳入优先审评程序,其中具有明显临床价值的新药占比最大,共191件,占45%,有33件具有明显临床价值的新药注册申请通过优先审评程序得以加快批准上市。
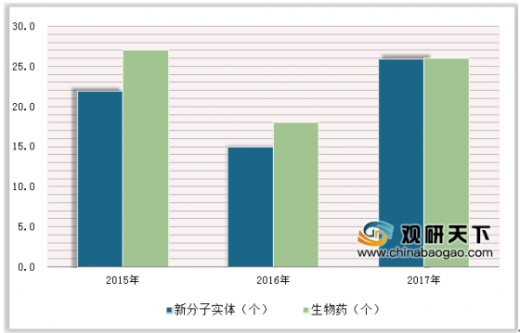
2003-2006年是第一波IND小高潮,2013年则开启了第二波IND大潮。此后自主新药IND数量逐年攀升,2017年,药监局受理IND合计131个(剔除疫苗)。2013到2020年,预计将有超过500个创新药处于临床阶段,并将在2020年后开始陆续进入临床后期和申报上市阶段,保证创新药能够长期持续产出。

随着鼓励药品研发创新的政策不断出台落地,国内药品研发迎来历史上最好的黄金时代,国内以恒瑞医药、复星医药等为首的龙头企业抓住行业机遇,持续加大研发投入,加快推进产品管线的构建及上市进程。随着市场对这些创新药企业的预期现金流改善及成长性加快的判断加强,在二级市场上,创新药企业迎来估值重建的行情,这一点在2017下半年以来的医药板块走势中已初见端倪,并有望继续加强,成为未来几年医药板块的最大主题之一。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。









