美国FDA及欧盟TPD对电子烟监管的新政策对大厂商的影响有别于小厂商。美国电子烟市场份额占全球的50%,是最大的电子烟市场。
FDA对电子烟的监管政策较为严格,2007年2月15日之后上市的电子烟产品,每一型号都需要单独进行上市预申请(PMTA)。进行PMTA申请需要提交一系列负担性的,花费高昂的报告文件。
提供符合FDA要求的上市预申请文件是一项既耗时间又耗财力的工作,据业内估计产品通过FDA认证需要花费一年到一年半的时间,上市预申请费用将达到数十万美元,中小企业恐难负担。随着FDA政策的执行,电子烟行业的门槛已经提高。
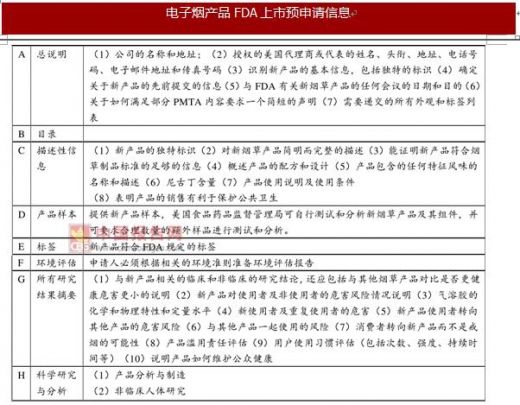
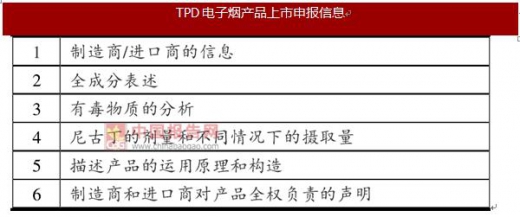
电子烟产品FDA上市预申请与TPD上市申请相比所需提交的材料更多、更细、更专业。电子烟产品要通过FDA审核难度更大,门槛更高。
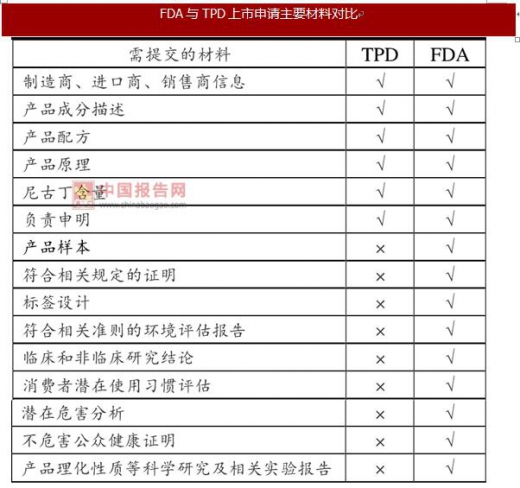
随着行业门槛的提高,产品竞争模式也将发生变化,FDA监管政策规定每款电子烟产品都需要进行产品预申请,导致产品的上市成本提高,产品的更新速度变慢,现如今市场上若干爆款产品与众多品类型号产品竞争发展的模式将发生根本性的改变。
在2018年11月8日上市申请到期后,电子烟产品数量将急剧减少,每个产品周期拉长,将呈现出各个产品销量相对均衡的结构。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。









